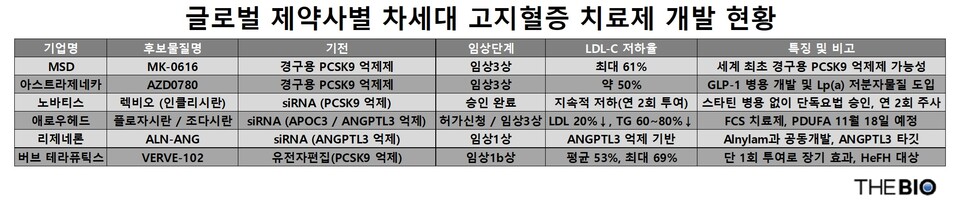
- MSD·AZ, 경구용 PCSK9 억제제로 복약 편의성 경쟁
- 노바티스·애로우헤드, siRNA 기반 장기 지속형 바카라 에볼루션 정착
- 버브, 염기편집 기술로 ‘1회 투여’ 지질 바카라 에볼루션 시대 예고
[더바이오 성재준 기자] 전 세계 고지혈증 치료 시장이 경구용(먹는약), 작은 간섭 RNA(siRNA), 유전자편집 기술의 부상으로 빠르게 다변화될 전망이다. 수십 년간 1차 치료제로 군림해온 ‘스타틴계 약물(Statins)’의 한계를 넘어서려는 신기술 경쟁이 본격화되면서 경구 복용의 편의성과 siRNA의 장기 지속 효과, 유전자편집의 1회 투여 가능성이 차세대 치료의 핵심 키워드로 떠오르고 있다.
27일 업계에 따르면다국적 제약사 MSD(미국 머크)를 비롯해 아스트라제네카(AZ),노바티스(Novartis)와 미국 바이오기업 애로우헤드파마슈티컬스(Arrowhead Pharmaceuticals, 이하 애로우헤드),미 바이오기업 버브테라퓨틱스(Verve Therapeutics, 이하 버브) 등이 차세대 바카라 에볼루션 개발에 뛰어들었다.
글로벌 시장조사 기업인 퍼시스턴스마켓리서치(Persistence Market Research)는 스타틴 계열의 글로벌 바카라 에볼루션 시장은 올해 166억달러(약 23조9000억원)에서 오는 2032년 206억달러(약 29조6600억원) 규모로 성장할 전망이다. 그러나 스타틴계 약물은 근육통 등 부작용 우려와 장기 복용 부담으로 복약 순응도는 낮은 편이다.
이에 업계는 PCSK9, ANGPTL3, APOC3, Lp(a) 등 새로운 표적을 겨냥한 혁신 바카라 에볼루션 개발에 속도를 내고 있다. 특히 siRNA와 유전자편집 약물은 투여 횟수를 크게 줄일 수 있는 점에서 스타틴계 약물 이후 차세대 치료옵션으로 주목받고 있다.
◇MSD·AZ, ‘경구용 PCSK9 억제제’로 복용 편의성 강화
MSD는 최근 경구용 PCSK9 억제제 후보물질인 ‘엔리시타이드 데카노에이트(Enlicitide Decanoate, 개발코드명 MK-0616)’의 임상3상(CORALreef HeFH·AddOn)에서 최대 61%의 LDL 콜레스테롤 저하 효과를 확인했다. 이 후보물질은 PCSK9 단백질과 LDL 수용체의 결합을 차단해 기존 항체 주사제 수준의 지질 저하 효과를 경구 제형으로 구현한 첫 사례로, 현재 대규모 추가 임상이 진행 중이다. 허가를 받을 경우 세계 최초의 경구용 PCSK9 억제제가 될 전망이다.
앞서 임상2b상에서는 LDL-C가 최대 60.9% 감소했으며, ApoB·non-HDL-C·Lp(a) 등 보조지표도 유의하게 개선됐다. MSD는 현재 진행 중인 임상3상 프로그램을 통해 LDL-C 저하뿐만 아니라, 주요 심혈관사건 예방 효과까지 확인할 계획이다.
AZ 역시 경구용 PCSK9 억제제 후보물질인 ‘AZD0780(개발코드명)’의 임상2b상(PURSUIT)에서 약 50%의 LDL-C 감소 효과를 확보하고, 3건의 임상3상에 진입했다. 이 후보물질은 복약 순응도와 접근성을 획기적으로 높일 수 있다는 점에서 시장 확대의 잠재력이 크다.
AZ는 이러한 임상 성과를 바탕으로 대사질환 전반으로 연구 범위를 확장하고 있다. 특히 비만 및 지질대사 이상을 포괄하는 전략의 일환으로, AZD0780을 핵심 파이프라인으로 육성 중이다. 또 중국 에코진(Eccogene)과 공동으로 개발하고 있는 글루카곤 유사 펩타이드1(GLP-1) 수용체 작용제(RA) 후보물질인 ‘AZD5004(개발코드명)’를 통해 대사·지질질환을 아우르는 복합 바카라 에볼루션 포트폴리오를 강화하고 있다.
최근에는 중국 제약사 씨에스피씨(CSPC Pharmaceutical Group)와 최대 20억달러(약 2조8800억원) 규모의 독점 라이선스(기술이전) 계약을 체결하고, 전임상 단계의 Lp(a) 표적 저분자 후보물질인 ‘YS2302018(개발코드명)’을 도입했다. 해당 계약에 따라 AZ는 선급금 1억달러(약 1400억원)와 최대 19억2000만달러(약 2조7600억원)의 개발·상업화 마일스톤(단계별 기술료) 및 단계별 로열티(경상기술료)를 지급하기로 합의했다. YS2302018은 전임상에서 Lp(a) 형성 억제 효능을 보여 AZD0780과의 병용 개발 가능성이 검토되고 있다.
◇노바티스·애로우헤드, siRNA로 장기 지속형 바카라 에볼루션 정착
노바티스의 ‘렉비오(Leqvio, 성분 인클리시란)’는 지난 8월 미국 식품의약국(FDA)으로부터 단독요법 적응증을 추가 승인받으며 ‘스타틴 병용 제한이 해제’됐다. 렉비오는 RNA 간섭(RNAi) 기술을 활용해 PCSK9 메신저 리보핵산(mRNA)을억제하고, 간의 LDL 수용체 발현을 증가시켜 LDL 콜레스테롤 수치를 낮춘다. 최초 1회 주사 후 3개월 뒤 한 차례 추가하고, 이후 6개월마다 연 2회 투여만으로 지속적인 지질 저하 효과를 보인다.
렉비오는 이번 라벨 변경으로 스타틴 병용 없이도 식이요법·운동 병행 시 ‘단독 처방’이 가능해졌으며, 원발성 고지혈증과 이형접합 가족성 고콜레스테롤혈증(HeFH) 모두에 사용된다. 노바티스는 RNAi 기술을 제공한 미국 앨라일람(Alnylam)과 라이선스 계약을 통해 글로벌 권리를 확보했으며, 앨라일람은 이 제품의 매출10~20%에 해당하는 로열티를 받는다.
애로우헤드는 siRNA 신약 후보물질인 ‘플로자시란(Plozasiran)’을 가족성 킬로미크론혈증(FCS) 바카라 에볼루션로 미국 식품의약국(FDA)에 허가 신청했다. 처방의약품 사용자 수수료법(PDUFA)에 따라 최종 승인 여부는 오는 11월 18일로 예정돼 있다. 임상3상에서 평가된 25㎎단일 용량으로 신약 허가 신청(NDA)을 진행했다.
플로자시란은 APOC3 단백질을 억제해 중성지방(TG)을 80% 이상 감소시키고, 췌장염 발생 위험을 83% 낮춘 임상3상(PALISADE) 결과를 확보했다. FDA는 플로자시란을 ‘혁신신약(Breakthrough Therapy)’, ‘희귀의약품(Orphan Drug)’, ‘패스트트랙(Fast Track)’ 대상으로 지정했으며, 유럽의약품청(EMA) 또한 희귀의약품으로 지정했다.
또 다른 siRNA 후보물질인 ‘조다시란(Zodasiran)’은 ANGPTL3를 억제해 LDL을 약 20%, 중성지방을 60% 이상 낮추는 효과를 보였다. 현재 이 후보물질은 고중성 지방혈증 환자를 대상으로 임상3상 단계에 진입했다.
미국 리제네론(Regeneron) 역시 앨라일람과 공동으로 개발 중인 ANGPTL3 억제 siRNA 후보물질인 ‘ALN-ANG(개발코드명)’을 통해 고중성 지방혈증 및 이상 지질혈증 바카라 에볼루션 영역에 진입했다. 현재 임상1상 단계로,향후 애로우헤드의 조다시란과 타깃 경쟁 구도를 형성할 것으로 보인다.
◇버브, 유전자편집으로 ‘1회 투여 바카라 에볼루션’ 가능성 제시
버브는 ‘염기편집(Base Editing)’ 기술을 활용한 유전자바카라 에볼루션 후보물질인 ‘VERVE-102(개발코드명)’가 임상1b상(Heart-2)에서 단 1회 정맥주사로 LDL-C를 평균 53%, 최대 69%까지 낮췄다고 밝혔다. 이 기술은 DNA 절단 없이 특정 염기를 교체하는 정밀 편집 방식으로, 기존 크리스퍼캐스나인(CRISPR-Cas9)보다 비표적(off-target) 돌연변이 위험과 면역반응 가능성을 크게 낮춘 점이 특징이다.
VERVE-102는 이전 세대 프로그램인 ‘VERVE-101(개발코드명)’의 전달체를 개선한 2세대 후보물질이다. 간세포 선택성을 높이고, 안전성을 강화했다. 이번 연구는 이형접합 가족성 고콜레스테롤혈증(HeFH) 환자를 대상으로 진행 중이며, 단회 투여만으로 장기 LDL-C 조절 효과를 평가하고 있다. 버브는 올해 하반기 용량 확장 연구를 완료한 뒤 글로벌 임상2상에 진입할 계획이다. 향후 ANGPTL3 등 다중 타깃 염기편집 프로그램으로 개발을 확대할 예정이다.

